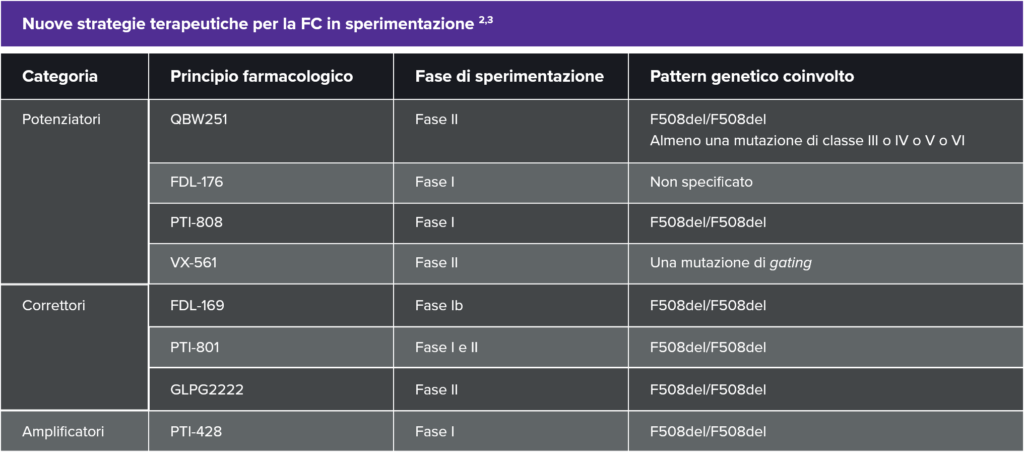
I modulatori rappresentano una nuova categoria di farmaci in grado di incrementare la sintesi (amplificatori), la processazione intracellulare (correttori) o di migliorare il difetto funzionale (potenziatori) della proteina CFTR. Attualmente in commercio sono disponibili:
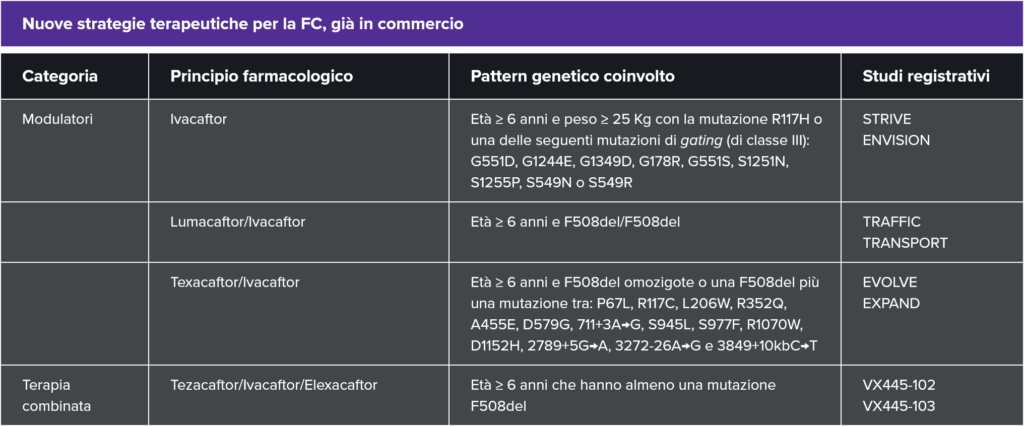
Negli studi clinici, ivacaftor ha migliorato la funzionalità polmonare, con un aumento medio della FEV1 del 10%; ha portato inoltre ad aumento del peso corporeo e a un generale miglioramento della qualità di vita dei pazienti con mutazioni di classe III. 3
Con ivacaftor, il valore di cloro nel sudore, che riflette la funzionalità in vivo di CFTR, è diminuito da un valore medio di 100 nmol/L fino a un valore medio di 50 nmol/L. I pazienti inoltre hanno sperimentato meno esacerbazioni.
In un setting di real life questi risultati si sono tradotti in una miglior sopravvivenza, in un minor numero di trapianti polmonari e in una minore insorgenza di complicanze. 4
Il farmaco è stato generalmente ben tollerato, nonostante sia stato osservato un innalzamento degli enzimi epatici in circa il 30% dei pazienti. 4
La combinazione di lumacaftor e ivacaftor è stata approvata a novembre 2015 da AIFA per pazienti FC di età ≥ 6 anni con mutazione omozigote F508del, pattern genetico che in Italia coinvolge circa il 22% dei pazienti. 2,5
Lumacaftor è un correttore di CFTR che agisce direttamente su F508del-CFTR per migliorarne l’elaborazione e il trafficking cellulare. Esso agisce insieme a ivacaftor e l’effetto combinato si traduce in un aumento della quantità e della funzione di F508del-CFTR sulla superficie della cellula, con conseguente aumento del trasporto di ioni cloruro. 5
L’efficacia di lumacaftor/ivacaftor in pazienti con FC omozigoti per la mutazione F508del è stata valutata in due studi clinici randomizzati (TRAFFIC e TRANSPORT), in doppio cieco, controllati verso placebo, condotti in 1.108 pazienti clinicamente stabili, nei quali 737 pazienti sono stati randomizzati al gruppo lumacaftor/ivacaftor e trattati con questa associazione.
I pazienti in entrambi gli studi sono stati randomizzati in rapporto 1:1:1 a ricevere lumacaftor 600 mg una volta al giorno/ivacaftor 250 mg ogni 12 ore, lumacaftor 400 mg ogni 12 ore/ivacaftor 250 mg ogni 12 ore, oppure placebo. I pazienti hanno assunto il farmaco con alimenti contenenti grassi per 24 settimane, in aggiunta alle terapie prescritte per la FC.
L’endpoint primario di efficacia in entrambi gli studi era la variazione assoluta rispetto al basale della ppFEV1 alla settimana 24.
Nel primo studio, la differenza tra tezacaftor/ivacaftor e placebo per l’endpoint primario della variazione media assoluta della ppFEV1, dal basale alla settimana 24 compresa, era di 4 punti percentuali (p<0,0001). Il miglioramento medio della ppFEV1 è stato osservato alla prima valutazione il giorno 15 ed è stato mantenuto durante tutte le 24 settimane del periodo di trattamento. I miglioramenti sono stati osservati indipendentemente dall’età, dal sesso, dai valori di ppFEV1 al basale e dalla colonizzazione da parte di Pseudomonas aeruginosa. 6
Anche nel secondo studio clinico, il trattamento con tezacaftor/ivacaftor in associazione a ivacaftor ha prodotto un miglioramento statisticamente significativo della ppFEV1.
In termini di tollerabilità, tezacaftor-ivacaftor è risultato generalmente sicuro; tezacaftor sembra essere meglio tollerato rispetto a lumacaftor e sembra essere associato a minori problematiche relative all’interazione con altri farmaci. 4
La combinazione dei tre modulatori tezacaftor, ivacaftor, elexacaftor (IVA/TEZ/ELX) è stata approvata da AIFA ad agosto 2020 ed è indicata in pazienti con FC di età ≥ 6 anni che hanno almeno una mutazione F508del nel gene CFTR. *
Elexacaftor e tezacaftor sono correttori di CFTR e agevolano l’elaborazione e il traffico cellulare di F508del-CFTR, Ivacaftor incrementa la probabilità di apertura del canale. L’effetto combinato dei tre modulatori si traduce in un aumento della quantità e della funzione della CFTR mutata sulla superficie cellulare.
*Attualmente In Italia Kaftrio è rimborsato dal sistema sanitario nazionale per i pazienti di età ≥12 anni.
In entrambi gli studi la triplice combinazione ha soddisfatto gli endpoint primari (variazione assoluta media della ppFEV1) e ha prodotto miglioramenti statisticamente significativi in tutti i principali endpoint secondari (numero di esacerbazioni, variazione assoluta dei valori di cloruro nel sudore, variazione del punteggio CFQ-R, variazione assoluta della BMI).
In particolare, è stato osservato un miglioramento medio assoluto della ppFEV1 di 14,3 punti percentuali rispetto al basale nel corso di 24 settimane di trattamento rispetto a placebo (p<0,0001) in pazienti con una mutazione F508del e una mutazione a funzione minima. Miglioramenti statisticamente significativi sono stati osservati in tutti gli endpoint secondari, compresa una riduzione del 63% nel tasso annuo di esacerbazioni polmonari rispetto al placebo (p<0,0001). 7
La triplice combinazione è stata generalmente ben tollerata nello studio di 24 settimane. La maggior parte degli eventi avversi è stata di grado lieve o moderato. Gli eventi avversi più comuni, che si sono verificati nel 15% o più dei pazienti, indipendentemente dal gruppo di trattamento, sono stati: esacerbazioni polmonari infettive, aumento dell’espettorato, mal di testa e tosse. 7,8
La triplice combinazione IVA/TEZ/ELX si è dimostrata in grado di migliorare la funzionalità polmonare, la BMI e la qualità di vita in adulti e bambini con almeno una copia della mutazione F508del. Nonostante le recenti evidenze prodotte relative all’efficacia e alla sicurezza di questa terapia nel breve periodo, risulta necessaria una continua valutazione degli outcome, tenendo in considerazione che si sta parlando di un trattamento che dovrà essere somministrato per la maggior parte della vita del paziente.
In questo contesto, diversi studi di real-world sono attualmente in corso con lo scopo di determinare la sostenibilità del miglioramento della triplice terapia osservato negli studi clinici, gli effetti extra-polmonari e la sicurezza a lungo termine.
I risultati ottenuti dagli studi osservazionali, combinati con le evidenze degli studi clinici controllati, saranno utili per comprendere le necessità sanitarie in continua evoluzione dei soggetti affetti da FC.